FLUOVIEW FV3000 공초점 현미경으로 다중화
쥐의 내측 전두엽의 형태 특성화
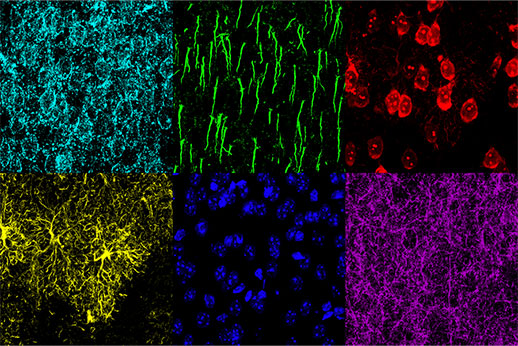
인지 장애 메커니즘 연구에는 형태적 변화를 생리학적 반응에 결부시키는 기능이 요구됩니다. 질병의 상태 및 치료가 뇌의 형태와 어떻게 관련되는지를 이해하는 데는 동일한 샘플 내 다중 형태적 구조를 식별할 수 있는 것이 중요합니다. 본 연구에서는 TruSpectral 검출기 기반의 FV3000 컨포칼 현미경을 사용하여 쥐의 내측 전두엽(mPFC) 내 6가지 구조(성상세포, 추체신경세포, 억제신경세포, 신경세포막, 축삭돌기 초기 부분, 핵)의 이미지를 획득하는 데 성공하였습니다.
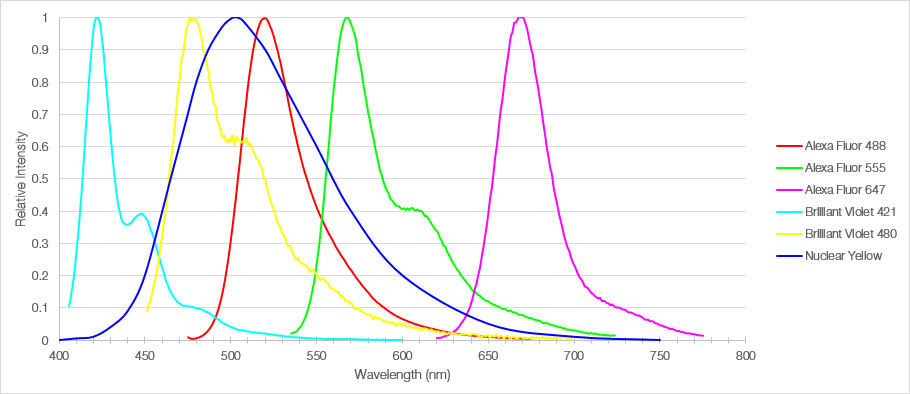
그림 1: 쥐의 내측 전두엽 부분을 표지하는 데 사용된 6개 형광단의 방출 스펙트럼.
TruSpectral 기술을 통해 가능한 6개 구조의 개별 식별
이 실험에서는 쥐의 내측 전두엽의 30µm 두께의 고정된 부분을 6개의 각기 다른 형광단으로 표지하였습니다. UPLSAPO20X 대물렌즈가 장착된 Olympus FV3000 컨포칼 현미경이 다중 뇌 조직의 3D 형광 이미지를 캡처하였습니다. 신호 검출을 최적화하고 출혈을 방지하기 위해 TruSpectral 검출을 이용하여 각 형광단에 대해 개별 획득 및 검출 매개변수를 설정하였습니다. 결과적 이미지는 개별 방출 프로필이 포함된 각 형광단의 밝은 신호를 생성하였으며 이를 통해 동일 샘플 내 다중 구조의 정확한 검출이 가능하였습니다.
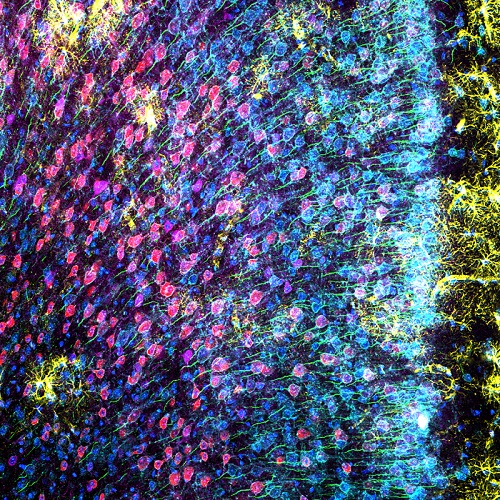
그림 2: 아교세포섬유산성단백질(GFAP, 성상세포 표지, 노란색), 칼모듈린의존성 단백질인산화효소 II(CaMKII, 추체신경세포 표지, 빨간색), 암포테린 유도 단백질 1 전구체(AMIGO-1, 신경세포막 표지, 청록색), 파브알부민(PV, 억제신경세포 표지, 자주색), 안키린-G(AnkG, 축삭돌기 초기 부분 표지, 녹색) 및 핵 노란색(핵 표지, 파란색)으로 표지된 쥐의 mPFC.
이미징 조건
현미경: FLUOVIEW FV3000 레이저 스캐닝 컨포칼 현미경(가상 채널 모드)
대물렌즈: 20X 건식 대물렌즈(UPLSAPO20X)
레이저: 405nm(BV421, 핵 노란색), 445nm(BV480), 488nm(AF488), 561nm(AF555) 및 640nm(AF647)
100X 실리콘 이멀젼 대물렌즈를 통해 가능한 개별 형태 구조의 고해상도 이미징
쥐의 mPFC의 고해상도 이미지를 획득하기 위해 TruSpectral 고감도 검출기와 함께 100X 실리콘 오일 대물렌즈를 사용하여 모두 6개 표지를 보이는 피질 부위의 밝은 상세 이미지를 획득하였습니다. 이러한 결합을 통해 연구원들은 내측 전두엽 내 신경세포의 각기 다른 집단의 형태를 분명히 관찰할 수 있었습니다.
(A) | (B) |
그림 3: 아교세포섬유산성단백질(GFAP, 성상세포 표지, 노란색), 칼모듈린의존성 단백질인산화효소 II(CaMKII, 추체신경세포 표지, 빨간색), 암포테린 유도 단백질 1 전구체(AMIGO-1, 신경세포막 표지, 청록색), 파브알부민(PV, 억제신경세포 표지, 자주색), 안키린-G(AnkG, 축삭돌기 초기 부분 표지, 녹색) 및 핵 노란색(핵 표지, 파란색)으로 표지된 쥐의 mPFC. (A) 6개 형광단의 개별 채널. (B) 오버레이 이미지.
이미징 조건
현미경: FLUOVIEW FV3000 레이저 스캐닝 컨포칼 현미경(가상 채널 모드)
대물렌즈: 100X 실리콘 오일 대물렌즈(UPLSAPO100XS)
레이저: 405nm(BV421, 핵 노란색), 445nm(BV480), 488nm(AF488), 561nm(AF555) 및 640nm(AF647)
FV3000 컨포칼 현미경에 의한 실험 촉진 방법
고효율 GaAsP 검출기가 포함된 전체 스펙트럼 시스템은 멀티플렉스 이미징을 위한 고감도를 제공합니다
| 모든 FV3000 컨포칼 현미경에 통합된 TruSpectral 검출 기술을 통해 기존 스펙트럼 검출 장치보다 더 높은 빛 처리량을 제공합니다. 부피 위상 홀로그램이 반사 화상보다 최대 3배 더 높은 전달 효율로 빛을 회절시킵니다. 각 TruSpectral 검출기의 감도를 독립적으로 조정하여 FV3000 현미경의 고감도 스펙트럼 검출기(HSD)와 함께 밝은 신호와 어둑한 신호를 모두 최적으로 분리할 수 있습니다. 더욱이 FV3000 시스템의 스펙트럼 디콘볼루션 알고리즘은 람다 스택 이미지로부터의 스펙트럼 정보를 기반으로 중첩 스펙트럼을 분리할 수 있습니다. 라이브 이미지 획득과 후처리 중 언믹싱 알고리즘으로 채널 간 형광 혼선을 제거할 수 있으며 이를 통해 최대 16개 형광단의 깨끗한 분리가 이루어집니다. | 관련 영상 |
두꺼운 조직의 밝은 이미지를 위한 UPLSAPO100XS 실리콘 오일 이멀젼 대물렌즈
UPLSAPO 슈퍼 아포크로맷 렌즈 대물렌즈는 구면 수차와 색수차를 모두 보정하며 가시 영역에서 근적외선 영역까지 투과율이 높습니다. 실리콘 오일의 굴절률(ne≈1.40)은 살아있는 조직의 굴절률(ne≈1.38)에 가까우므로 이를 통해 최소 구면 수차 및 정확한 3D 형태로 살아있는 조직 내부의 심도 있는 고해상도 관찰을 할 수 있습니다.
|
배율: 100X
NA: 1.35 (실리콘 오일 이멀젼) W.D.: 0.2mm 색수차의 보정 레벨: 슈퍼 아포크로맷 렌즈(SAPO) |
FV3000 현미경을 사용하여 분자 레벨에서 신경병성 통증이 뇌에 미치는 영향 연구
Stephanie Shiers의 견해
 | 본 연구는 신경병성 통증에서 내측 전두엽(mPFC) 의존적인 인지 장애에 초점을 맞추고 있습니다. 외피 기능 장애에 관련된 세포 유형을 해명하고 이들 세포의 기능상 변화에 대한 통찰을 얻기 위해 mPFC의 구조적 가소성을 연구하였습니다. 인지 과제의 성과 부진과 관련된 신경병성 통증이 있는 수컷 쥐의 mPFC에서 축삭돌기 초기 부분(AIS)의 길이 감소를 관찰하였습니다(Shiers 등, J Neurosci 2018, Shiers 등, 신경정신약리학, 2019). 이들 세포 유형의 형태에 대한 이해는 무엇이 통증이 있는 인지 기능 장애의 기저를 이루고 있는 것인지와 이를 치료할 수 있는 방법에 대한 실마리를 제공합니다. FV3000 현미경을 사용한 고해상도 이미징이 mPFC 미세 구조의 분석에 대단히 중요하였습니다. |
Dr. Theodore Price의 견해
 | 본 연구의 주목적은 신경병성 통증이 인지 처리와 직접적으로 관련이 있는 뇌 구조에 어떻게 영향을 미치는지 이해하는 것입니다. 인지 문제가 신경병성 통증의 중요한 동반질환이라는 것을 알지만, 분자 기초에 대해서는 아는 바가 거의 없습니다. 쥐의 PFC에 대한 연구를 통해 신경병성 통증에 의해 야기되는 AIS의 미세한 변화가 밝혀졌습니다. FV3000 현미경을 통한 PFC의 초미세 구조의 최고 품질 이미지 획득 능력은 신경병성 통증의 이러한 중요한 측면을 이해하는 새로운 방법을 제시하였습니다. |
감사의 말
이 애플리케이션 노트는 다음 연구원들의 도움으로 작성되었습니다.
Stephanie Shiers 텍사스 대학 댈러스 캠퍼스 Price Lab, 박사과정학생
Theodore J. Price, 박사, Price Lab, Eugene McDermott 교수, 책임자,
텍사스 대학 댈러스 캠퍼스 행동및뇌과학부 신경생물학과 고등통증연구센터
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.